上:https://lawaxi.net/d/28/2
在《上》中,我们介绍了分子轨道理论和如何解释共轭二烯的稳定性的一些问题(引子);但是在有机化学中,分子轨道理论(前线轨道理论)主要被用于解释周环反应的立体专一性(Stereospecifically)。前人曾经用同样的方法把类似的反应规律都综合到了一个规则中,即Woodward-Hoffman rules,您甚至不需要计算和画分子轨道,直接查表即可获得结论,但这似乎对我们学习并没有好处。
周环反应包括电环化、环加成、sigma迁移与烯反应,一般是以五、六元环为中间态,电子在环内按一个方向移动,有时只是双键位置的移动(电环化和sigma迁移),有时会有一根双键和两根单键之间的转化(环加成,烯反应)。具体内容在各种的有机化学教材上都有涉及,环加成可以以D-A反应(Diels-Alder reaction)为例。

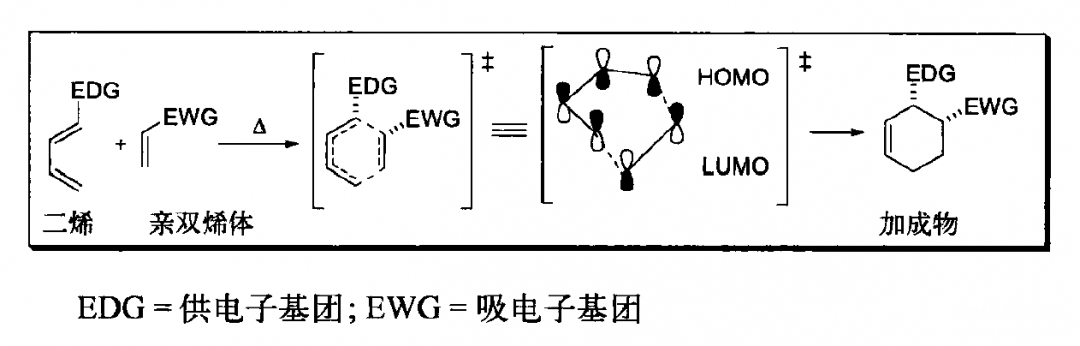
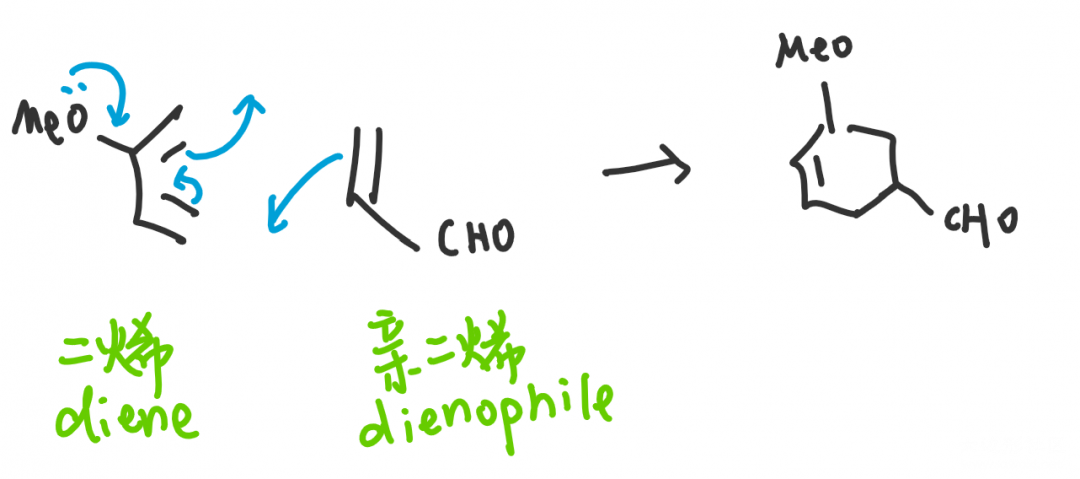
D-A反应中分别在二烯和亲二烯中加入推电子和吸电子基团的目的,就是让二烯中HOMO能量升高,亲二烯中LUMO能量下降,使之匹配以提高反应效率。周环反应都是分子轨道之间的重组,让电子从HOMO中更容易流出和更容易流入LUMO一直都是我们需要考虑的,包括在考虑本文着重讲述的立体专一性上。我们首先来了解HOMO(最高占据分子轨道)和LUMO(最低未占据分子轨道)的概念。
前线轨道理论 Frontier Molecular Orbital Theory(FMO)
前线轨道理论是分子轨道理论的重要衍生。我们从前一章讲过,有机化学研究细节,因此我们显然应当关注电子流入流出的位置,而不是关注所有的分子轨道,这是没有用处的。我们以一个四个碳的体系为例,电子总是从能量高的轨道流出,显然π₂在π₁上面,因此π2电子是最先流出的电子,我们称π₂轨道为最高(电子)占据分子轨道HOMO(Highest Occupied Molecular Orbital);而电子流入时会流入能量最低的轨道,空着的π₃与π₄轨道中,π₃在下面,是最先接受电子的,我们称π₃为最低未占据分子轨道LUMO(Lowest Unoccupied Molecular Orbital)。
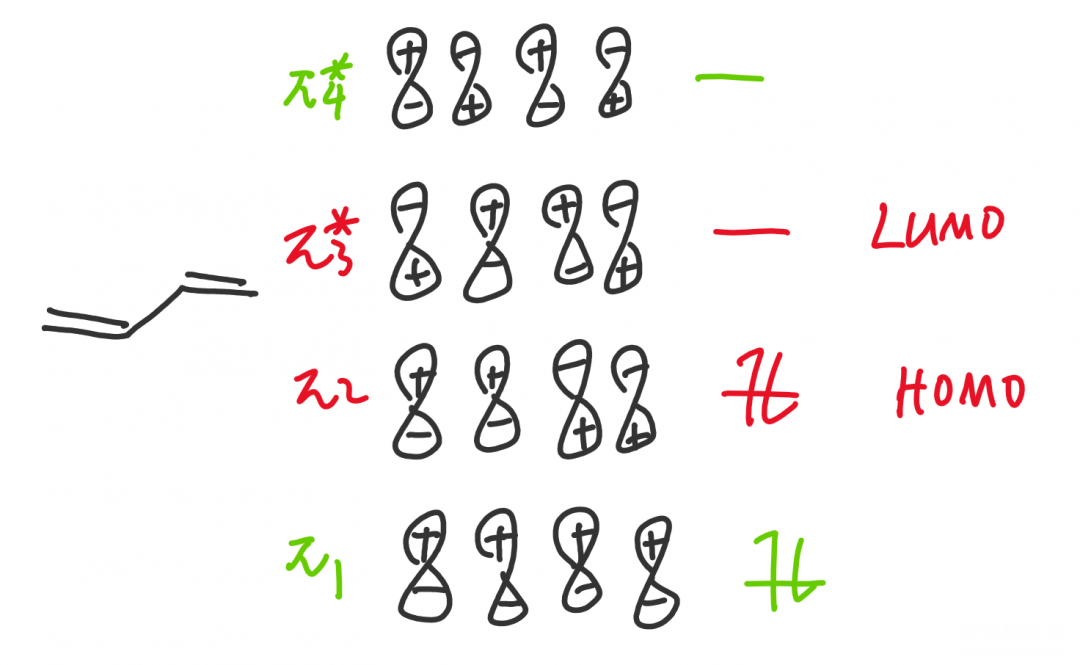
HOMO和LUMO统称为前线轨道(Frontier Molecular Orbital),是在反应中走在最前面的轨道,其他的轨道用处不明显,在解释问题是亦可不画。在单电子体系中,如自由基反应时,前线轨道的位置只有一个电子,被称为SOMO(Single Occupied Molecular Orbital),电子既可流入又可流出,这时没有HOMO和LUMO的概念,SOMO本身被称为前线轨道。
本文主要以《Art》上一个经典的例子讲解这一概念,我们在接下来的环节中只会画出HOMO和LUMO轨道,而不会再考虑其他轨道,如果您思考着不方便,也可以先画出来。
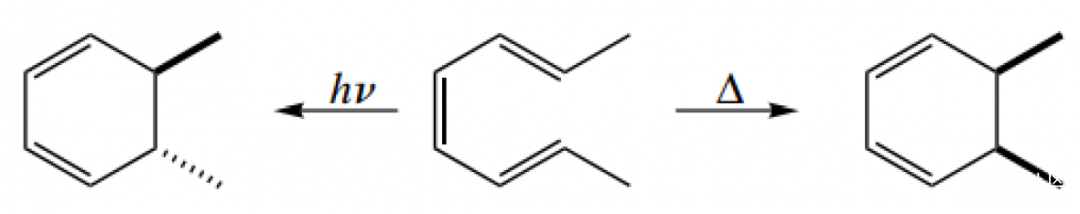
2,4,6-辛三烯在光照(hν)或加热(△)条件下进行电环化,甲基分别处于反式(trans)和顺式(cis)结构。这其中是怎么一回事呢?小编也不知道,请朋友们在评论区留下自己的意见吧。
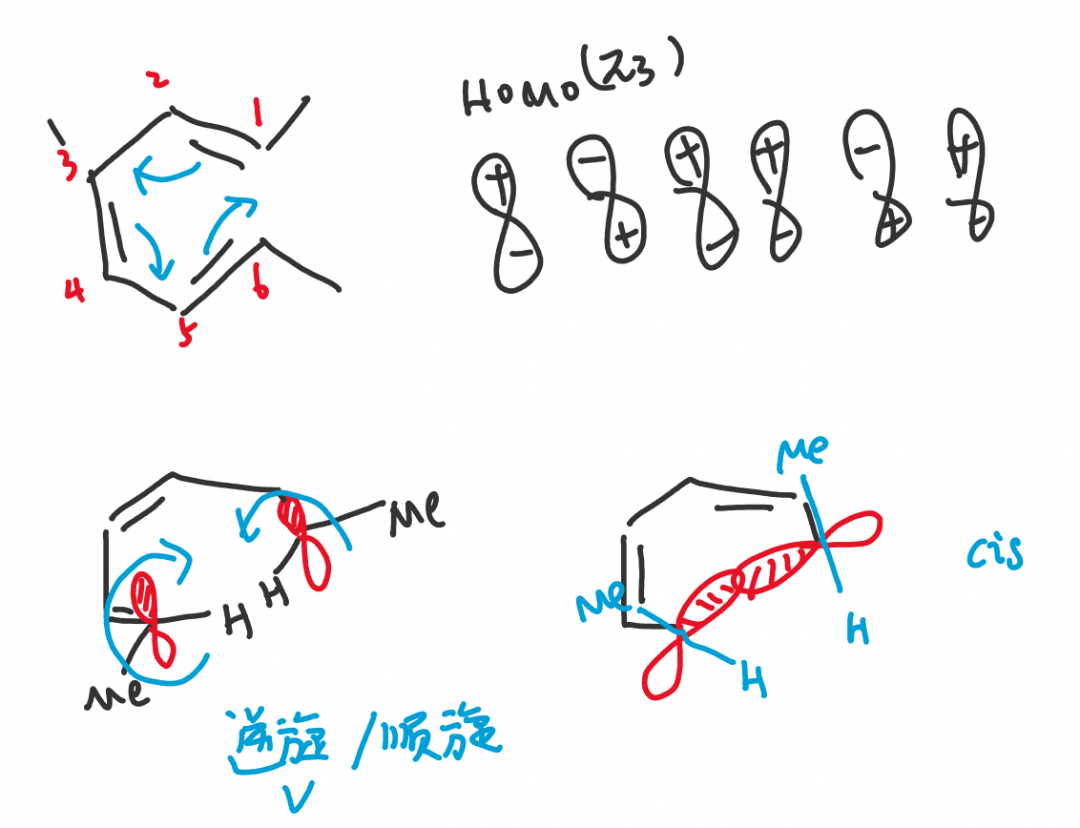
六电子体系加热条件,HOMO轨道为π₃,成键时要求相位一致,因此两端的原子需要对旋(disrotatory)转动,随之两个甲基形成顺式结构。在光照条件下,电子被激发,因此HOMO轨道转为π₄,根据我们上一篇文章讲到的轨道对称性交替排列,π₃和π₄两个轨道的1,6位相位对称性恰恰相反,最终甲基形成反式结构。
这是Woodward-Hoffman rules的一个具体举例,Woodward-Hoffman rules其实就是按照这种理论归纳成了规律,按照体系中原子的奇偶,是否加热总结了如下的表格:
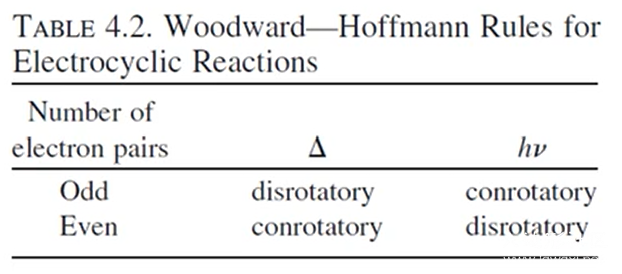
Woodward-Hoffman rules总结 图源:《有机反应机理的书写艺术》
本文完。
